AGD forårsaket av (Neo)paramoeba perurans sprer seg nordover etter to varme somre, med utbrudd i PO8 og PO9.
Amøben (Neo)paramoeba perurans ble første gang påvist i Norge i 2006 på fire lokaliteter med oppdrett av atlantisk laks (Salmo salar L.) på Vestlandet. Siden 2014 har N. perurans forårsaket en rekke alvorlige sykdomsutbrudd med amøbegjellesykdom (AGD) og etablert seg som en betydelig utfordring for oppdrettsnæringen.
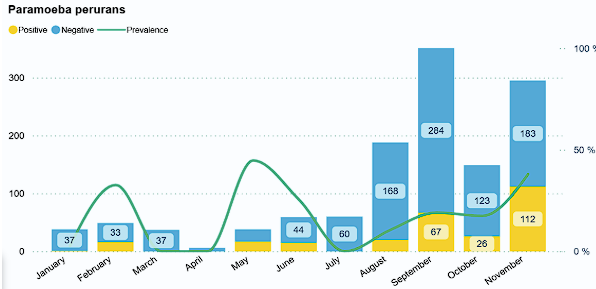
Den geografiske utbredelsen av sykdommen varierer, men AGD har fram til nå utgjort en risiko i det marine miljøet i produksjonsområdene PO1–PO7. For N. perurans ser vi et tydelig sesongmønster, med de første påvisningene i juli–august etterfuglt av en økende forekomst utover høsten, for så å avta utover vinteren med synkende sjøvannstemperaturer. Globalt er sykdommen assosiert med høye sjøvannstemperaturer (>12 °C), men kliniske utbrudd i Norge er dokumentert helt ned i 6–7 °C (Steinum et al., 2008; Mo et al., 2014). Saltholdighet over 25 ‰ gir økt risiko, og lokaliteter med høy salinitet (rundt 35 ‰) er erfaringsmessig mest utsatt for utbrudd.
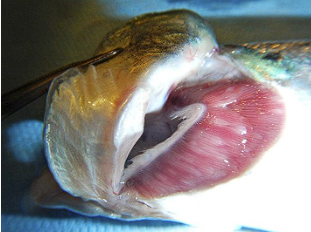
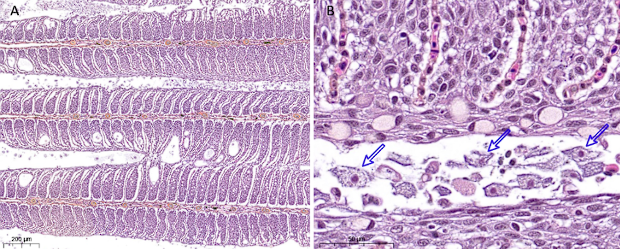
Ved kliniske utbrudd sees ofte fisk med respirasjonsproblemer som gir sløv fisk med utstående gjellelokk og nedsatt appetitt. På gjellene framstår sykdommen som lyse flekker eller hevelser, som representerer områder hvor amøben har kolonisert og påvirket vevet. Histologisk kjennetegnes lesjonene av epitelhyperplasi, sammenvoksing av lameller og tilstedeværelse av amøber (Taylor et al., 2009).
Somrene 2024 og 2025 har vært uvanlig varme i de nordlige produksjonsområdene (PO8-PO13). Dette har ført til økt lusepress, og en økning i både smittsomme og ikke-smittsomme gjellelidelser, også i områder som tidligere har hatt god gjellehelse i sjø. Per desember 2025 påvises N. perurans mer frekvent i PO8 sammenlignet med tidligere år, og i PO9 er amøben påvist med klinisk synlige gjelleforandringer, real-time RT-PCR og histopatologiske funn.
I august publiserte vi artikkelen «Gjellehelse i sjø – med fokus på smittsomme årsaker» på iLaks. Prognosen vi la frem der viste seg å slå til utover høsten, særlig i nordområdene hvor gjellehelseutfordringer ble tydelige. Erfaringene fra 2025 bekrefter at prognosearbeid gir verdifull innsikt og bør brukes aktivt i planlegging av forebyggende tiltak og beredskap i oppdrettsnæringen.
Hva ser vi i felt
Trendene i analysearbeidet samsvarer med felterfaringene fra Nordlandskysten høsten 2025 sier Mattias Bendiksen Lind i HaVet fiskehelse. Det kliniske helsebilde har beveget seg i en bekymringsverdig retning. Området har tradisjonelt hatt en stabil og nokså oversiktlig helsesituasjon, men de siste sesongene har en økt forekomst av kliniske gjellelidelser og andre sykdomsutfordringer skapt en langt mer kompleks situasjon. Vi ser nå en økning av tilfeller med klinisk gjellesyk fisk, og flere lokaliteter melder om denne typen helseutfordringer.
Denne høsten har vi for første gang registrert klinisk sykdomsutvikling der AGD inngår som en sentral del av et sammensatt gjellebilde. Det er etter alt å dømme også gjennomført de første behandlingene mot AGD i regionen. Alt tyder på at vi står ved et veiskille, der aktører i PO8 må forberede seg på å håndtere sykdomsutfordringer som hittil i hovedsak har preget de sørlige produksjonsområdene. For å møte utfordringene må både overvåking, beredskap og forebygging styrkes. Systematisk kartlegging blir da et avgjørende verktøy for å kunne sette inn tiltak før problemer oppstår.
Metoder for påvisning og overvåking
Gjellesykdommer kan oppdages og følges opp på ulike måter. Real time RT-PCR på gjellevev eller svaber er spesielt nyttig for å identifisere sykdomsfremkallende agens tidlig i smitteforløpet. Samtidig gir histopatologiske undersøkelser et tydelig bilde av hvordan sykdommen utvikler seg og hvor alvorlig vevsskaden er. Ingen metode gir alle svar alene, men sammen gir de et helhetlig grunnlag for riktige tiltak. Derfor bør real time RT-PCR alltid kombineres med histologiske prøver for å bekrefte mistanker om sykdom.
PatoGen og HaVet oppfordrer oppdrettsnæringen til å rette økt oppmerksomhet mot gjellehelse i nord. Det er sannsynlig at redusert gjellehelse vil bli en stadig større utfordring i årene fremover. God gjellehelse er avgjørende både for fiskevelferd og produksjon, og et nært samarbeid mellom næringen og fagmiljøene er essensielt for å håndtere utfordringene effektivt.
Kilder:
Mo, T. A., Emilsen, V., Hansen, H., Poppe, T. (2014). Smitteforsøk med isolat av Paramoeba perurans fra berggylt og laks for å studere mottakelighet og infeksjonsutvikling hos laks. Veterinærinstituttets rapportserie.
Steinum, T., Kvellestad, A., Rønneberg, L.B., Nilsen, H., Asheim, A., Fjell, K., Nygård, S.M.R., Olsen, A.B., Dale, O.B. (2008). First cases of amoebic gill disease (AGD) in Norwegian seawater farmed Atlantic salmon, (Salmo salar, L). and phylogeny of the causative amoeba using 18S cDNA sequences. Journal of Fish Diseases. 31: 205-214.
Taylor, R.S., Muller, W.J., Cook, M.T., Kube, P.D., Elliott, N. G. (2009). Gill observations in Atlantic salmon, (Salmo salar, L.) during repeated amoebic gill disease (AGD) field exposure and survival challenge. Aquaculture. 290: 1-8.
Kliniske forandringer på gjeller fra Atlantisk laks smittet med N.perurans (AGD) utført i kontrollert forsøk. Foto: Martin Huun-Røed
Histologiske bilder (HES-farget) av gjeller fra atlantisk laks som viser (A) uttalt, diffus hyperplasi av epitel resulterende i segmental sammenvoksning av lameller med sparsom forekomst av kavernedannelser, samt (B) forekomst av amøber (eksempler indikert med piler) i tilknytning til AGD-lesjonene. PatoGen, Anette Nordby.